Главная>
Мониторинг среды>
Загрязняющие вещества>
Загрязняющие вещества 2 класса опасности
Цинк.
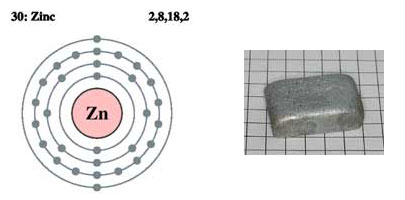
Цинк – серебристо-белый металл, относится к группе тяжелых металлов. Содержание в земной коре 8,3х10-3% по массе.
Источники поступления цинка в окружающую среду.
Цинк широко распространен в природе в виде соединений: сульфида, карбоната, оксида и силиката в комбинации со многими минералами, в количестве, составляющем приблизительно 0,02% Земной коры.
Антропогенные источники вносят вклад в загрязнение атмосферного воздуха цинком вдвое больший, чем природные. Из техногенных источников основным загрязнителем окружающей среды цинком является цветная металлургия (около 50% общего выброса), черная металлургия.
Цинк выделяется из печей в виде пыли, дыма, пара. Оксид цинка, или белый цинк образуется при окислении парообразного чистого цинка или при обжиге руды оксида цинка.
Влияние на здоровье человека.
Цинк является микроэлементом, необходимым для нормального функционирования человеческого организма в малых дозах. Он входит в состав 40 металлоферментов, играющих важную роль в метаболизме нуклеиновых кислот и синтезе белков. Металлический цинк мало токсичен. Фосфид и оксид цинка ядовиты. Попадание в организм растворимых солей цинка приводит к расстройству пищеварения, раздражению слизистых оболочек.
Цинк относится к веществам 2 класса опасности.
Формальдегид.
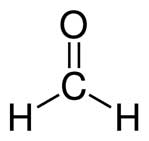
Формальдегид или муравьиный альдегид, или метаналь: НСНО. Бесцветный газ с резким раздражающим запахом.
Чистый газообразный формальдегид относительно стабилен при 80-100°С, при температурах ниже 80°С медленно полимеризуется; процесс ускоряется в присутствии полярных растворителей (в т.ч. воды), кислот и щелочей.
Формальдегид хорошо растворяется в воде, спиртах и др. полярных растворителях. При низких температурах смешивается в любых соотношениях с неполярными растворителями: толуолом, диэтиловым эфиром, этилацетатом, СНСl3 (с увеличением температуры растворимость падает), не растворяется в петролейном эфире.
Формальдегид обладает высокой реакционной способностью.
Источники формальдегида.
Антропогенные источники включают непосредственные эмиссии при производстве и промышленном использовании и вторичные (окисление углеводородов, выбрасываемых стационарными и мобильными источниками).
Формальдегид поступает в водную среду в результате сброса коммунальных и промышленных сточных вод, а также в процессе вымывания его из атмосферного воздуха. В дождевой воде городов фиксируется присутствие формальдегида. Формальдегид – сильный восстановитель. Он конденсируется с аминами, с аммиаком образует уротропин. В водной среде подвергается биодеградации, которая обусловлена действием бактерий.
Фоновые концентрации составляют несколько мкг/м3, в городском воздухе достигают величин 0,005-0,01 мг/м3. Вблизи промышленных источников – выше. Кратковременные пиковые концентрации в застроенных городских районах (в часы пик или в условиях фотохимического смога) примерно на порядок выше.
Миграция формальдегида в окружающей среде.
Формальдегид вымывается из воздуха дождевыми водами. Водный раствор является сильным восстановителем. Он конденсируется с аминами, с аммимаком образует уротропин. В водной среде формальдегид подвергается деградации, обусловленной действием ряда бактерий. В стерильной воде формальдегид не разлагается.
Атмосфера промышленных городов характеризуется очень высокими концентрациями формальдегида. Наиболее высокие концентрации вещества наблюдаются в городских застройках в часы пик или в условиях фотохимического смога.
Влияние на живые организмы.
Формальдегид – раздражающий газ, обладающий общей ядовитостью. Он оказывает общетоксическое действие. Вызывает поражение ЦНС, легких, печени, почек, органов зрения. Возможно кожно-резорбтивное действие. Формальдегид обладает аллергенным, мутагенным, сенсибилизирующим, канцерогенным действием.
Предполагается, что основным путем поступления формальдегида в организм является ингаляционный. Курение – дополнительный источник. Поступление с водой – пренебрежимо мало. Опасен при попадании на кожу, слизистые, при вдыхании.
Формальдегид официально назван канцерогеном.
Основной путь поступления формальдегида в организм – ингаляционный.
Класс опасности вещества – 2.
Фториды.
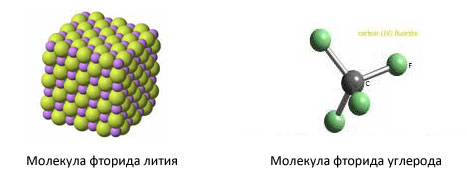
Фториды – химические соединения фтора с другими элементами. Фториды большинства металлов (соли фтористоводородной кислоты) – кристаллы с высокими температурами плавления. Фториды неметаллов – жидкости и газы.
Фториды практически нерастворимы в воде, мало растворимы в спиртах, углеводородах, хорошо – в эфире, хлорпроизводных углеводородов.
При обычных температурах – мало реакционно-способны, на холоде на них не действуют ни концентрированные кислоты, ни щелочи.
Фториды – исключительно теплостойки. Некоторые монофториды имеют тенденцию к самопроизвольному разложению с образованием фтороводорода и углеводорода. Моно-фторированные углеводороды также легко гидролизуются, лучше всего кислотами. Особенно термостойки фториды, в которых водород полностью замещен фтором- фторуглероды и перфторуглероды.
Фториды относят ко 2 классу опасности – вещества, умеренно опасные.
Источники поступления фторидов в окружающую среду.
Фториды существуют в окружающей среде, в природе: в воде, в почве, в горных породах и др. Но влияние на их существование в естественном виде на окружающую среду крайне низко, по сравнению с антропогенными источниками.
Антропогенными источниками выбросов фторидов служат металлургическое производство, электросварка, производство удобрений, алюминия, эмалевое производство, отдельные виды получения стекол, обработка хрусталя, получение хладагентов, пластмасс, обогащение урана, нанесение покрытий и т.д.
Фенолы.
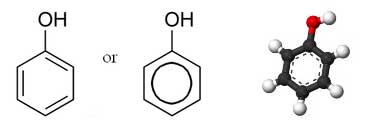
Фенолы – это производные соединения бензола, они содержат гидроксильную группу, присоединенную к бензольному кольцу.
К группе фенолов относят фенол, резорцинол, гидрохинон, пирогаллол, пентахлорфенол, бромфенолы, йодфенолы, катехол, пирокатехол, крезолы.
Влияние на здоровье человека.
Фенол легко абсорбируется через кожу и желудочно-кишечный тракт, а пары фенола легко абсорбируются через легкие. Токсичное воздействие фенола непосредственно связано с концентрацией свободного фенола в крови. Фенол является общим протоплазматическим ядом и токсичен для всех клеток.
Фенол относится к группе веществ 2 класса опасности по влиянию на здоровье населения.
Оксиды азота.
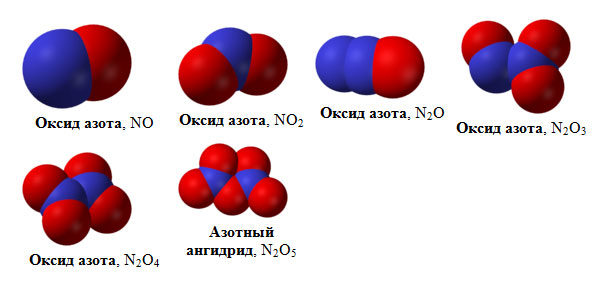
Азот образует несколько соединений с кислородом:
В конце 20 века природные циклы азота претерпели существенные изменения. С одной стороны интенсификация земледелия привела к быстрому снижению запасов гумуса и азота в почвах, с другой стороны – резко возросло поступление в окружающую среду оксидов азота в результате развития транспорта, авиации, теплоцентралей. Значительное количество оксидов азота в окружающую среду поступает в результате сжигания ископаемого топлива. При работе теплоэнергетических объектов при высоких температурах в ядре факела топочных камер котлов большой мощности происходит частичное окисление азота воздуха и азота топлива с образованием оксида и диоксида азота.
Техногенные выбросы азота в атмосферный воздух включают в основном оксид азота и его диоксид. Мировое количество этих выбросов приближается к 37 млн. тонн в год без учета отходящих газов нефтепереработки.
Максимальное количество оксидов азота дают промышленно развитые страны, причем около 97% этого количества приходится на промышленно развитое Северное полушарие. Однако в небольших концентрациях диоксид азота обнаруживается и на значительном расстоянии от источников выбросов – над Тихим океаном, над Серной Атлантикой, на Гавайях.
Оксиды азота активно участвуют в фотохимических реакциях, продуцируя озон и азотную кислоту. В настоящее время серьезную проблему представляют не глобальное, а региональное и локальное загрязнение воздуха оксидами азота.
Антропогенез существенно нарушил естественные процессы биологической фиксации и миграции азота, хотя биогенные источники вносят преобладающий вклад в накопление связанного азота в биосфере по сравнению с техногенным.
Половина производимого человеком оксида азота образуется в результате сжигания топлива в промышленных установках, а другая половина – за счет работы автотранспорта. Таким образом, действующий двигатель внутреннего сгорания служит основным антропогенным источником NO в атмосфере.
Попадая в атмосферу оксид азота постепенно превращается в диоксид путем взаимодействия с озоном и гидроперекисными радикалами. Таким образом, оксиды азота накапливаются в нижних слоях атмосферы. Их присутствие вызывает кислотные дожди и сказывается на последующих превращениях химически активного компонента атмосферы – кислорода.
Оксиды азота, поглощая естественную радиацию как в ультрафиолетовой, так и в видимой части спектра, снижают прозрачность атмосферы и способствуют образованию фотохимического тумана-смога.
Влияние на человека, животных, растения, микроорганизмы.
Оксид азота (NO) в высоких концентрациях содержится в атмосферном воздухе только вблизи источников выбросов. Монооксид азота не раздражает дыхательные пути человека и поэтому человек может его не почувствовать. При вдыхании NO образует с гемоглобином нестойкое нитросоединение, которое быстро переходит в метгемоглобин, при этом железо +2 переходит в железо +3. Ион железа +3 не может обратимо связывать кислород и таким образом, выходит из процесса перенесения кислорода. Концентрация метгемоглобина в крови выше 60-70% считается летальной. Такое значение может быть создано только в закрытом помещении. Оксид азота действует на нервную систему человека, вызывает параличи и судороги, связывает гемоглобин крови и вызывает кислородное голодание.
По мере удаления от источника выбросов все большее количество NO переходит в NO2. NO2 - желто-коричневый газ, особенно сильно раздражает слизистые оболочки. При контакте с влагой в организме образуются азотистая и азотная кислоты, которые разъедают стенки альвеол легких. При этом, стенки альвеол и кровеносных капилляров становятся настолько проницаемы, что пропускают сыворотку крови в полость легких. В этой жидкости растворяется вдыхаемый воздух, образуя пену, препятствующую дальнейшему газообмену. При длительном действии оксидов азота следует опасаться расширения клеток в корешках бронхов (тонкие разветвления воздушных путей альвеол). Ухудшения сопротивляемости легких к бактериям, а также расширения альвеол.
В промышленных районах и городах наблюдается концентрация NO2 в пределах 0,4-0,8 мг/м3, а при образовании смога – до 1 мг/м3.
Оксиды азота действуют на растения двумя путями: с помощью кислотных осадков, прямым контактом с растениями и косвенно путем фотохимического образования окислителей. В форме кислотных остатков оксиды азота наносят ущерб растениям, увеличивая кислотность. Прямой контакт растений с оксидами азота можно сразу определить зрительно по пожелтению или по бурению листьев и игл. Причиной такого изменения окраски является превращение хлорофиллов α и β в феофитины и разрушения каротиноидов. Образующаяся в клетках азотистая кислота оказывает мутагенное действие, при этом происходит окислительное дезаминирование нуклеиновых кислот (например, цитозин превращается в урацил).
При взаимодействии нитритов и аминов в живых организмах образуются нитрозоамины, являющиеся канцерогенами, способными вызывать нарушения хромосомного аппарата и наследственные уродства.
Высокие концентрации оксидов азота в атмосферном воздухе приводят к учащению случаев катара верхних дыхательных путей, бронхита и воспаления легких у населения. Люди с хроническими заболеваниями дыхательных путей (астма, эмфизема легких), а также лица, страдающие сердечно-сосудистыми заболеваниями, могут быть более чувствительными к прямым воздействиям оксидов азота, у таких людей чаще развиваются осложнения при кратковременных респираторных инфекциях.
Диоксид азота имеет 2 класс опасности, оксид азота - 3.
Озон.
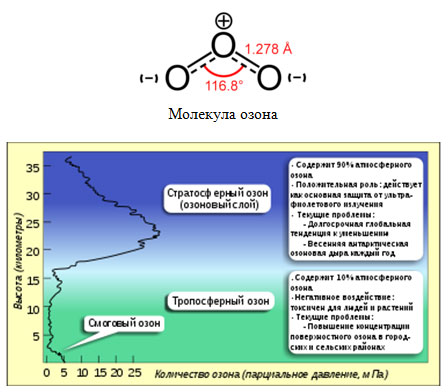
Действие озона на организмы подобно действию NO2. Он также воздействует на легкие и вызывает отеки легких. Кроме того, озон нарушает нормальное движение мерцательных волосков в бронхах, которые должны выводить чужеродные вещества из бронхов вместе с мокротой. Систематическое вдыхание озона приводит к накоплению в легких чужеродных веществ, что может привести к увеличению опасности заболевания раком легких, так как канцерогенные вещества задерживаются в легких больше обычного.
При действии на растения озон значительно токсичнее, чем оксиды азота. Чувствительные виды растений уже после часовой обработки озоном при концентрации 0,05-0,1 мг/м3 проявляют признаки угнетения. Озон изменяет структуру клеточных мембран. При этом сначала повышается проницаемость по отношению к воде, а затем к глюкозе. В результате этих процессов отмирают клетки мезофилла листьев, на поверхности образуются полости, в которых происходит полное отражение света. В этом случае говорят о появлении серебристой пятнистости листьев. Благодаря физиологическим условиям в клетке озон, возможно с помощью ароматических соединений, образует радикалы ОН-, которые реагируют с глянцевым слоем кожицы листьев и игл, в результате чего на этом слое появляются трещины и он становится хрупким. В трещинах могут, например, прорастать грибные споры, проникающие затем вглубь листа и разрушающие его.
Окислительные процессы, активизированные в клетках, воздействуют на систему этиленовых связей между стенками и мембраной клетки, при этом может выделяться этилен, индуцирующий опадение листьев и игл.
Алюминий.
Алюминий – химический элемент VIII группы периодической системы, самый распространенный в Земной коре металл, около 8,6% общей массы. В почвах содержится 150-6 - мг/кг элемента, в атмосферном воздухе городов – около 10 мкг/м3, в сельской местности – 0,5 мкг/м3.
В виде простого вещества алюминий – серебристо-белый металл, характеризуется высокой тягучестью, теплопроводностью и электропроводностью. На воздухе покрывается оксидной пленкой. Оксид алюминия представляет собой белую, очень тугоплавкую и нерастворимую в воде массу. От источников загрязнения поступает в окружающую среду с частичками техногенной пыли и распространяется по динамическим законам в окружающей среде.
Накоплению алюминия в почве способствует ее закисление. При закислении водных объектов нерастворимые формы алюминия переходят в растворимые, что способствует резкому повышению его концентраций в воде.
Источники техногенного загрязнения.
Электротехника, авиационная, химическая, нефтеперерабатывающая промышленность, машиностроение, строительство, оптика, ракетная и атомная техника.
Влияние на живые организмы.
Токсичность алюминия проявляется во влиянии на обмен веществ, в особенности, минеральный, на функции нервной системы, в способности действовать непосредственно на клетки – их размножение и рост. Избыток солей алюминия снижает задержку кальция в организме, уменьшает адсорбцию фосфора, одновременно увеличивая содержание алюминия в костях, печени, семенниках, мозге и паращитовидной железе. К важнейшим клиническим проявлениям нейротоксического действия относят нарушение двигательной активности, судороги, снижение и потерю памяти, психопатические реакции.
При вдыхании пыли или дыма с примесью алюминия поражаются, главным образом, легкие. В почках и сердце также могут отмечаться изменения межуточной ткани. Развивается узелковый и диффузных пневмосклероз, склероз сосудов легких и печени. Пыль алюминия раздражает слизистые оболочки глаз, носа и т.д. Могут развиваться дерматиты, экземы.
Никель.
Никель – химический элемент VIII группы периодической системы Менделеева, серебристо-белый металл.
Никель – элемент земных глубин, среднее содержание его в земле – около 3%. Промышленные месторождения никеля (сульфидные руды) обычно сложены минералами никеля и меди.
Нахождение в природе и пути миграции.
В биосфере никель – сравнительно слабый мигрант. Его мало в поверхностных водах, в живом веществе. Миграция никеля носит сложный характер. С одной стороны, никель мигрирует из почвы в растения, поверхностные и подземные воды, с другой – его количество в почве постоянно пополняется вследствие разрушения почвенных минералов, отмирания и распада растений и микроорганизмов, а также за счет внесения в почву с атмосферными осадками, удобрениями и т.д. Исследование содержания металла в различных гранулометрических фракциях почвы показало, что значительная его часть концентрируется в мелких, илистых, богатых гумусом фракциях почвы.
Антропогенные источники поступления никеля в окружающую среду.
Важнейшими источниками загрязнения никелем окружающей среды являются предприятия горнорудной промышленности, цветной металлургии (89% общего поступления в окружающую среду), машиностроительные, металлообрабатывающие, химические предприятия. Сюда можно отнести также ТЭС, работающие на мазуте и каменном угле и другие производства, использующие в качестве источника энергии ископаемые углеводородные топливные материалы.
В промышленном городе поступление никеля в окружающую среду складывается из атмосферных выпадений 5,669 мг/сут., твердых отходов – 1126 мг/сут. и сточных вод 9,05 мг/сут. на человека.
Курение также является антропогенным источником загрязнения атмосферы. Одна сигарета содержит никеля 2,2-2,3 мкг, около 10-20% которого высвобождается в газовой фазе в струе сигаретного дыма при курении.
Никель мигрирует от источника загрязнения на частицах пыли. По исследованиям ученых, в районе работы топливно-энергетических предприятий рассеяние металлов, в том числе и никеля, наблюдается в радиусе до 50 км. Причем, по некоторым исследованиям, отмечается увеличение содержания никеля в пыли по мере удаления от источника. Интенсивность загрязнения никелем окружающей среды характеризуется также выпадением металла с атмосферными осадками даже в относительно чистых районах Земли (Антарктида, районы Индийского и Тихого океанов).
Биологическая роль никеля.
Никель является необходимым микроэлементом для млекопитающих и растений, обнаруживается во всех биологических материалах. В организме человека он входит в ряд ферментов. Никель участвует в регуляции метаболизма гемма в печени и почках.
Влияние на живые организмы.
Цельный металлический никель – не опасен для живых организмов. Пыль, пары никеля и его соединений – токсичны. Никель – канцерогенное вещество. ПДКмр никеля – 0,001 мг/м3.
Никель – вещество 2 класса опасности.
Общим качеством для всех видов никельсодержащих аэрозолей в пирометаллургических производствах является высокая степень дисперсности взвешенной в воздухе пыли (размеры частиц менее 1 мкм) и связанные с этим глубина проникновения в дыхательные пути, интенсивность воздействия на организм.
Никель – вещество общетоксического действия на организм. Помимо общетоксических эффектов хроническая интоксикация приводит к возникновению заболеваний носоглотки, легких, появлению злокачественных новообразований и аллергическим поражениям в виде дерматитов и экзем.
Поступление никеля в организм в природных условиях происходит, главным образом, с продуктами питания и питьевой водой. Кроме того, никель поступает в организм с атмосферным воздухом, через кожу – при контактах с никелированными предметами обихода.
Марганец.
Марганец – элемент VIII группы, относится к тяжелым металлам.
Нахождение и миграция в природных средах.
Марганец широко распространен в природе и содержится как в земной коре, так и водах морей и рек. По приблизительным оценкам средняя концентрация марганца в земной коре составляет около 1000 мг/кг.
В атмосферном воздухе содержание марганца незначительно. В сельских районах – примерно 0,01-0,03 мкг/м3, в крупных городах, не имеющих металлургических предприятий, среднегодовые концентрации марганца составляют 0,03-0,07 мкг/м3.
При попадании в почву марганец, благодаря деятельности микроорганизмов подвергается биологическому окислению или восстановлению в формы Мn3+ и Mn2+ соответственно. Реакции зависят от значения рН, аэрации почвы, температуры. Растения поглощают марганец в форме Mn2+.
Антропогенные источники загрязнения.
Марганец поступает в атмосферу от выбросов предприятий черной металлургии (60% всех выбросов марганца), машиностроения и металлообработки (23%), цветной металлургии (9%), многочисленных мелких источников, например, сварочных работ. Марганец является составляющей промышленной пыли и мигрирует в окружающей среде с частичками пыли.
Биологическая роль марганца.
Марганец поступает в организм, в основном, через желудочно-кишечный тракт и частично респираторным путем. Поступление через кожу – незначительно.
Марганец относится к важнейшим из жизненно необходимых микроэлементов и участвует в регуляции главных биохимических процессов. Марганец участвует в основных нейрохимических процессах в центральной нервной системе, в образовании костной и соединительной тканей, регуляции жирового и углеводного обмена, обмене витаминов С, Е, холина и витаминов группы В. В крови человека и большинства животных содержание марганца составляет около 0,02 мг/л. Суточная потребность взрослого организма составляет 3–5 мг Mn. Марганец оказывает влияние на процессы кроветворения и иммунную защиту организма.
Влияние на здоровье человека
Избыточное накопление марганца в организме сказывается, в первую очередь, на функционировании центральной нервной системы. Это проявляется в утомляемости, сонливости, ухудшении функций памяти. Марганец является политропным ядом, поражающим также легкие, сердечно-сосудистую и гепатобиллиарную системы, вызывает аллергический и мутагенный эффект.
Класс опасности вещества – 2. ПДКмр – 0,01 мг/м3 (10 мкг/м3).
Бензол и его ближайшие гомологи.
Бензол и ближайшие гомологи (толуол, этилбензол, ксилол) – относят к группе ароматических углеводородов, они содержат устойчивые циклические группы атомов (бензольные ядра), с особым характером химических связей.
Ароматичность молекулы означает ее повышенную устойчивость, обусловленную делокализацией электронов в циклической системе.
Бензол и его ближайшие гомологи – бесцветные жидкости со специфическим запахом. Ароматические углеводороды легче воды и в ней не растворяются, однако легко растворяются в органических растворителях – спирте, эфире, ацетоне. Чрезвычайно горючи.
Источники ароматических углеводородов.
Главные источники – это перегонка угля и ряд нефтехимических процессов, в частности каталитический реформинг, перегонка сырой нефти и алкилирование низших ароматических углеводородов. Полициклические углеводороды присутствуют в дыме, содержащемся в атмосфере городов.
Источником загрязнения атмосферы может являться металлургическая промышленность, автотранспорт.
Содержание бензола в воздухе обычно составляет 3-160 мкг/м3 (0,003-0,16 мг/м3), более высокие концентрации отмечаются в крупных городах. В селитебной зоне концентрация бензола обычно составляет 3-30 мкг/м3 (0,003-0,03 мг/м3) и зависит в основном от интенсивности движения автотранспорта.
Фоновый уровень толуола в атмосфере составляет 0,75 мкг/м3 (0,00075 мг/м3).
Влияние на живые организмы.
Абсорбция этих соединений происходит через дыхательные пути, желудочно-кишечный тракт и, в небольших количествах, через неповрежденную кожу.
В целом, моноалкильные производные бензола более токсичны, чем диалкильные производные, а производные с разветвленными цепями более токсичны, чем с прямыми цепями.
Бензол является человеческим канцерогеном. Обычно попадает в организм через легкие и ЖКТ. Вещество имеет 2 класс опасности по классификации воздействия на живые организмы. Наибольший риск возникновения заболеваний возникает при попадании в организм ингаляционным путем. Питьевая вода не является важным источником поступления в организм.
При хроническом воздействии бензол накапливается в жировой ткани. В высоких концентрациях нейротоксичен, при хроническом воздействии может приводить в поражению костного мозга. Обладает гемотоксическими эффектами (воздействует на клетки крови).
Толуол попадает в организм главным образом через дыхательные пути и, в меньшей степени, через кожу. Непосредственная токсичность толуола выше, чем у бензола. Относится к веществам 3 класса опасности. Толуол раздражает глаза, при высоких дозах наблюдаются функциональные нарушения центральной нервной системы.
Ксилол, подобно бензолу является наркотиком, вещество 3 класса опасности.
Этилбензол может попадать в организм при вдыхании его паров и, являясь растворителем жира, путем абсорбции через неповрежденную кожу, вещество 3 класса опасности.
Сероводород.
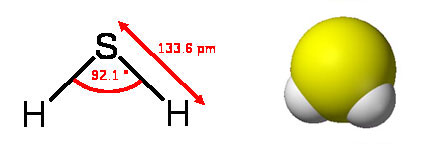
Сероводород – газ, тяжелее воздуха, на открытом воздухе может скапливаться в малопроветриваемых низинах в больших концентрациях.
Сероводород - термически неустойчив (при температурах более 400°С разлагается на простые элементы).
Класс опасности – 2, имеет запах тухлых яиц. ПДКмр равно 0,008 мг/м3.
Нахождение в природе и техногенные источники.
В природе сероводород встречается в составе нефти, природного газа, вулканических газов и в горячих источниках.
Поступает в атмосферу раздельно или вместе с другими соединениями серы. Основными источниками выброса являются предприятия по изготовлению искусственного волокна, сахара, коксохимические, нефтеперерабатывающие, а также нефтепромыслы.
Среднее содержание в атмосфере 0,3 мкг/м3 (0,0003 мг/м3). Достаточно высокие концентрации могут наблюдаться вблизи точечных источников (до 0,20 мг/м3).
Трансформация в окружающей среде.
В атмосфере при взаимодействии с другими загрязнителями подвергаются медленному окислению до серного ангидрида. Конечным продуктом реакции является аэрозоль или раствор серной кислоты в дождевой воде, который подкисляет почву.
Некоторые фотосинтезирующие бактерии, например, зеленые серные бактерии, в качестве донора водорода используют сероводород.
Влияние на живые организмы.
Сероводород – весьма токсичное вещество, так как является ингибитором фермента цитохромоксидазы – переносчика электронов в дыхательной цепи. Он блокирует перенос электронов с цитохромоксидазы на кислород.
Токсичность сероводорода проявляется в раздражающем действии на слизистые оболочки глаз и верхних дыхательных путей, угнетении тканевых дыхательных ферментов. При хронической интоксикации развиваются функциональные нарушения нервной системы, упадок питания, малокровие, бронхит, дрожание пальцев и век, боли в мышцах и по ходу нервных стволов. Вызывает поражение дыхательных путей и глаз.
В высоких дозах нарушают тканевое дыхание, возможно прямое поражение центральной нервной системы с параличом дыхательного центра. В тяжелых случаях отравления – наблюдается токсический отек легких и кома, в при молниеносных – паралич дыхания и сердечной деятельности.
Длительное и систематическое воздействие приводит к снижению иммунобиологической реактивности организма, увеличению общей неспецифической заболеваемости, в том числе заболеваниями легочной системы, неврозами.
Железо.

Железо – химический элемент VIII группы, серебристо-белый металл. По содержанию в литосфере железо стоит на втором месте после алюминия (4,65% по массе). Железо энергично мигрирует в земной коре, образуя порядка 300 минералов.
Техногенные источники.
Железо – лидер металлов и оно поступает в окружающую среду в максимальном количестве. Техногенное рассеивание железа совершается с такой интенсивностью, что его содержание в почвах земного шара удвоится через 50-60 лет. Локальной техногенной аномалией является зона металлургических комбинатов, в твердых выбросах которых содержатся 22000-31000 мг/кг железа. В прилегающие к комбинатам почвы поступает до 31-42 мг/кг железа. Это отражается на почвообразовательном процессе и на загрязнении растительной продукции, выращиваемой на данных территориях.
Биологическая роль.
Железо необходимо живым организмам для кислородного обмена и окислительных процессов. Физиологическая роль железа обусловлена его способностью образовывать различные комплексные соединения с молекулярным кислородом, азотом, серой. Железосодержащие белки обладают различными жизненно-важными функциями: гемоглобин транспортирует кислород, миоглобин запасает его в связанном виде, цитохромы обеспечивают тканевое дыхание.
Влияние избыточного содержания на организм человека.
При контакте человека с железом и его соединениями проявляется общетоксическое действие металла, раздражающее действие на верхние дыхательные пути.
Соединения железа (II) обладают общим токсическим действием, соединения железа (III) менее ядовиты, но действуют прижигающее на пищеварительный тракт.
Аэрозоли (пыль, дым) железа и его оксидов при длительном воздействии откладываются в легких и вызывают сидероз.
Медь.

Медь - металл, относящийся к группе тяжелых металлов. Среднее содержание меди в Земной коре составляет 4,7х10-3%, общие мировые ее запасы в рудах оцениваются в 465 млн. тонн.
Техногенные источники.
Годовой объем техногенных поступлений меди в окружающую среду составляет: 56 тысяч тонн в атмосферу, 77 тысяч тонн с отходами, 94 тысячи тонн с удобрениями.
Медь поступает в воздух с выбросами металлургических производств. В выбросах твердых веществ она содержится в основном в виде соединений, преимущественно оксида меди. На долю предприятий цветной металлургии приходится 98,7% всех антропогенных выбросов этого металла.
Биологическая роль.
Медь - один из важнейших микроэлементов. Физиологическая активность меди связана главным образом с включением ее в состав активных центров окислительно-восстановительных ферментов. При участии меди осуществляются процессы синтеза белков, жиров и витаминов. Медь участвует в процессах фотосинтеза и влияет на усвоение азота растениями.
«назад» |