Главная>
Мониторинг среды>
Загрязняющие вещества>
Загрязняющие вещества 4 класса опасности
Оксид углерода (угарный газ).
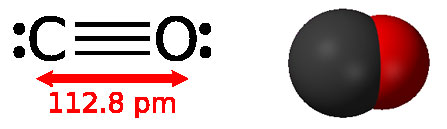
Оксид углерода – бесцветный газ, не имеющий запаха, немного легче воздуха, плохо растворим в воде, имеет температуру кипения: – 191,5°С. На воздухе загорается при температуре 700°С и сгорает синим пламенем до СО2.
Источники поступления в окружающую среду.
Монооксид углерода входит в состав атмосферы (10%). В атмосферу оксид углерода попадает в составе вулканических и болотных газов, в результате лесных и степных пожаров, выделения микроорганизмами, растениями, животными и человеком. Из поверхностных слоев океанов в год выделяется 220х106 тонн оксида углерода в результате фоторазложения красных, сине-зеленых и др. водорослей, продуктов жизнедеятельности планктона. Естественный уровень содержания оксида углерода в атмосферном воздухе – 0,01-0,9 мг/м3.
Угарный газ попадает в атмосферу от промышленных предприятий, в первую очередь металлургии. В металлургических процессах при выплавке 1 млн. тонн стали образуется 320-400 тонн оксида углерода. Большое количество СО образуется в нефтяной промышленности и на химических предприятиях (крекинг нефти, производство формалина, углеводородов, аммиака и др.). Еще одним немаловажным источником оксида углерода является табачный дым. Высока концентрация оксида углерода в угольных шахтах, на углеподающих трассах. Оксид углерода образуется при неполном сгорании топлива в печах и двигателях внутреннего сгорания. Важным источником оксида углерода является автомобильный транспорт.
В результате деятельности человека в атмосферу ежегодно поступает 350-600х106 тонн угарного газа. Около 56-62% этого количества приходится на долю автотранспорта (содержание оксида углерода в выхлопных газах может достигать величины 12%).
Поведение в окружающей среде.
При обычных условиях монооксид углерода инертен. Он химически не взаимодействует с водой. Растворимость СО в воде около 1:40 по объему. В растворе способен восстанавливать соли золота и платины до свободных металлов уже при обычной температуре. Не реагирует СО также с щелочами и кислотами. Взаимодействует с едкими щелочами только при повышенных температурах и высоких давлениях.
Убыль оксида углерода в окружающей среде происходит за счет его разложения почвенными грибами. Кроме того, при избытке кислорода в почвах тяжелого механического состава, богатых органическими веществами, имеет место переход СО в СО2.
Воздействие на организм человека.
Оксид углерода чрезвычайно ядовит. Допустимое содержание СО в производственных помещениях составляет 20 мг/м3 в течение рабочего дня, 50 мг/м3 в течение 1 часа, 100 мг/м3 в течение 30 минут, в атмосферном воздухе города максимальная разовая (за 20 мин) – 5 мг/м3, среднесуточная ПДК – 3 мг/м3. Естественный уровень содержания оксида углерода в атмосферном воздухе – 0,01-0,9 мг/м3.
СО вдыхается вместе с воздухом и поступает в кровь, где конкурирует с кислородом за молекулы гемоглобина. Оксид углерода, имея двойную химическую связь, соединяется с гемоглобином более прочно, чем молекула кислорода. Чем больше СО содержится в воздухе, тем больше молекул гемоглобина связывается с ним и тем меньше кислорода достигает клеток организма. Нарушается способность крови доставлять кислород к тканям, вызываются спазмы сосудов, снижается иммунологическая активность человека, сопровождающиеся головной болью, потерей сознания и смертью. По этим причинам СО в повышенных концентрациях представляет собой смертельный яд.
СО нарушает фосфорный обмен. Нарушение азотистого обмена вызывает зотемию, изменение содержания белков плазмы, снижение активности холинэстеразы крови и уровня витамина В6. Угарный газ влияет на углеводный обмен, усиливает распад гликогена в печени, нарушая утилизацию глюкозы, повышая уровень сахара в крови. Поступление СО из легких в кровь обусловлено концентрацией СО во вдыхаемом воздухе и длительностью ингаляции. Выделение СО происходит главным образом через дыхательные пути.
Больше всего при отравлении страдает ЦНС. При вдыхании небольшой концентрации (до 1 мг/л) – тяжесть и ощущение сдавливания головы, сильная боль во лбу и висках, головокружение, дрожь, жажда, учащение пульса, тошнота, рвота, повышение температуры тела до 38-40°С. Слабость в ногах свидетельствует о распространении действия на спинной мозг.
Чрезвычайная ядовитость СО, отсутствие у него цвета и запаха, а также очень слабое поглощение его активированным углем обычного противогаза делают этот газ особенно опасным.
Класс опасности вещества - 4.
Аммиак.
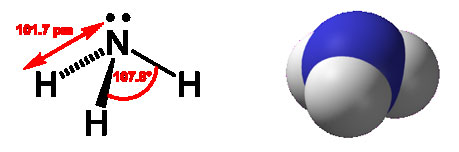
Аммиак – бесцветный газ с резким запахом, температура плавления – 80°С, температура кипения – 36°С, хорошо растворяется в воде, спирте и ряде других органических растворителей. Синтезируют из азота и водорода. В природе образуется при разложении азотсодержащих органических соединений.
Нахождение в природе.
В природе образуется при разложении азотсодержащих органических соединений.
Резкий запах аммиака известен человеку с доисторических времен, так как этот газ образуется в значительных количествах при гниении, разложении и сухой перегонке содержащих азот органических соединений, например мочевины или белков. Не исключено, что на ранних стадиях эволюции Земли в ее атмосфере было довольно много аммиака. Однако и сейчас ничтожные количества этого газа всегда можно обнаружить в воздухе и в дождевой воде, поскольку он непрерывно образуется при разложении животных и растительных белков.
Антропогенные источники поступления в окружающую среду.
Основными источниками выделения аммиака являются азотнотуковые комбинаты, предприятия по производству азотной кислоты и солей аммония, холодильные установки, коксохимические заводы и животноводческие фермы. В районах техногенного загрязнения концентрации аммиака достигают величин 0,015-0,057 мг/м3, в контрольных районах – 0,003-0,005 мг/м3.
Влияние на организм человека.
Этот газ токсичен. Человек способен почувствовать запах аммиака в воздухе уже в ничтожной концентрации – 0,0005 мг/л, когда еще нет большой опасности для здоровья. При повышении концентрации в 100 раз (до 0,05 мг/л) проявляется раздражающее действие аммиака на слизистую оболочку глаз и верхних дыхательных путей, возможна даже рефлекторная остановка дыхания. Концентрацию 0,25 мг/л с трудом выдерживает в течение часа даже очень здоровый человек. Еще более высокие концентрации вызывают химические ожоги глаз и дыхательных путей и становятся опасными для жизни. Внешние признаки отравления аммиаком могут быть весьма необычными. У пострадавших, например, резко снижается слуховой порог: даже не слишком громкие звуки становятся невыносимы и могут вызвать судороги. Отравление аммиаком вызывает также сильное возбуждение, вплоть до буйного бреда, а последствия могут быть весьма тяжелыми – до снижения интеллекта и изменения личности. Очевидно, аммиак способен поражать жизненно важные центры, так что при работе с ним надо тщательно соблюдать меры предосторожности.
Хроническое воздействие сублетальных доз аммиака приводит к вегетативным расстройствам, повышению возбудимости парасимпатического отдела нервной системы, жалобы на слабость, недомогание, насморк, кашель, боли в груди.
Класс опасности вещества – 4.
«назад» |